Olá profs! O que acham de trabalhar oxirredução com seus alunos através de um experimento simples, com materiais comuns do dia a dia e de fácil acesso? As aulas que trago nesse post utilizam água sanitária e pregos (simulando chaves) como forma de iniciar o assunto.
Essa sequência didática foi uma proposta apresentada à disciplina de Laboratório de Ensino de Química II da Udesc por mim, Karoline, e por meu colega Cleomar Copatti com o objetivo de iniciar o assunto de oxirredução através de ideias da estrutura da matéria. Por isso, por nunca ter aplicado com nenhuma turma do Ensino Médio, não sei dizer exatamente quais são as impressões dos alunos e as minhas ao dar essa aula. Então, se utilizarem, não deixem de comentar como foi ou ajustes que vocês fariam, tá bem? 😀
Inicio o assunto, utilizando slides, com um problema que aconteceu comigo. (Atualização: Abaixo está a versão de todos os slides para visualização, mas coloquei miniaturas à medida que fui os apresentando porque na época que escrevi esse post não sabia como pôr a apresentação de slides inteiras).
Apresento a água sanitária e pergunto a sua utilidade. Para limpar e desinfetar, certo? A imagem abaixo apresenta o 3º slide.
Aqui em casa minha família sempre diz que ela é uma ótima ideia para limpar tudo, que limpa que é uma beleza!
Quando eu era mais jovem, tinha umas chaves que estavam meio sujas. Então eu pensei: “Por que não colocar elas na água sanitária?! Vão ficar limpas!”
Só que quando eu fiz isso, depois de um tempo percebi que o oposto do que eu queria aconteceu! Elas ficaram mais sujas ainda!
Então, após apresentar esse problema, nós e a turma vamos tentar entender o que aconteceu! Por que será que a água sanitária, que tudo limpa, sujou minhas chaves?
Só que antes de conseguirmos entender isso, precisamos ver como os átomos geralmente se comportam nas reações químicas através de um exemplo mais simples. Para isso, vamos utilizar a reação de formação do NaCl como exemplo.
Então é explicado como vocês podem ver ali em cima, do macroscópico para o microscópico, partindo das imagens para a explicação química, para facilitar a visualização e a compreensão por parte dos nossos alunos ;).
Antes havia uma ligação metálica, no caso do Na, e ligação covalente, no caso do Cl2. Mas, quando formou o sólido, esses átomos não estavam mais como antes. Agora estavam na forma de íons. Assim, vamos tentar entender por que eles ficaram dessa forma :D. O slide mostra a imagem ampliada que acabou tampando o resto. Por isso, no fim desse post disponibilizo os slides para download e o arquivo da sequência didática, assim vocês podem conferir ele normalmente ;).
Em seguida, temos novamente a reação e vemos que depois da transformação química, a espécie ficou com cargas, mas que antes não havia carga alguma, por isso o número de oxidação no caso do sódio metálico é 0.
Relembramos também das estruturas atômicas e utilizamos a Tabela Periódica. Neste post falei sobre uma Tabela Periódica que eu mandei imprimir em formato de banner, bem grande, e que pode ser utilizada em aula. Se vocês quiserem, podem mandar imprimir também e utilizar com seus alunos durante as aulas. Eles podem ter suas tabelas periódicas pequenas também, mas acredito que quando o professor tem uma grande e leva para sala, facilita muito a visualização :D.
Lembrando que deve ser deixado claro que as imagens que mostram esses exemplos dos átomos com essas camadas é só uma representação, que os átomos não são planos dessa forma. Pode ser comentado sobre a diferença do tamanho entre os átomos de sódio e cloro, que provavelmente eles devem ter visto no primeiro ano ao estudar a Tabela Periódica, mas que possivelmente não lembram. Como os átomos estão ambos no mesmo período da Tabela Periódica, eles têm a mesma camada como a última. No entanto, o cloro tem mais prótons e por isso a atração entre os prótons e os elétrons é maior, se comparado ao sódio. Assim, o raio atômico do cloro é menor e seu átomo é menor. É importante que isso fique claro, porque após a reação química esses tamanhos variam e isso é possível de ser observado naquela imagem da estrutura cristalina do NaCl que foi mostrado anteriormente e que será mostrada novamente nos slides seguintes.
Em seguida, é visto por que o número de oxidação do Cl2 é zero, apesar de não estar em sua forma atômica. Então, analisamos o que acontece em relação aos elétrons nessa reação química através das ideias da estrutura dos átomos.
Dessa forma, o átomo de cloro ganha esse 1 elétron, se tornando Cl- e ficando maior devido às repulsões eletrônicas. O sódio, por sua vez, fica menor por ter perdido esse elétron da última camada ao se tornar Na+.
Como podemos ver, condiz com a estrutura cristalina :D, os íons sódio (em cinza), menores que os cloreto (verde).
Depois, vemos os termos de oxidação e redução, agente oxidante, agente redutor e número de oxidação.
Depois pode ser visto que pela Tabela Periódica se pode fazer uma previsão da perda ou ganho de elétrons baseado nas explicações que foram feitas anteriormente ;).
Partimos então para um exemplo de oxirredução do dia a dia. Nessa imagem abaixo não é possível visualizar, mas montei uma sequência de imagens (poderão ver ao baixar os slides no final desse post) que mostra só o portão de Fe, depois o gás O2 presente no ambiente, formando então o Fe2O3. Novamente, mostrando do macroscópico para o microscópico para facilitar a visualização.
Posteriormente, é visto em termos químicos o que ocorre. Como a imagem abaixo indica, nenhum elétron some, vai pro além (haha). Os mesmos 12 elétrons que são perdidos pelos átomos de ferro são ganhados pelos oxigênios.
Em seguida, são dados outros exemplos com imagens animadas de reações de oxirredução no dia a dia.
Então, vemos qual é o processo de oxirredução na queima do carvão, algo que os alunos conhecem e não é tão fora da sua realidade. Essa foi uma das preocupações ao montar essas aulas, sabe. Não trazer vários compostos químicos aleatórios que os alunos nunca viram e não faz tanto sentido para eles, que eles ficam pensando que aprender química é inútil. Química não é inútil :(.
Depois das explicações de oxirredução, é voltado ao problema inicial que eu tinha das chaves e desenvolve-se uma aula experimental. O ideal é que os próprios alunos façam essa atividade e não simplesmente seja demonstrado pelo professor.
Para isso, são utilizados pregos para simular as chaves porque as chaves são caras, né? haha. Se for dar essa aula, faça um teste com o prego antes porque dependendo de sua composição pode ser que não oxide!
Os alunos então receberão 2 pregos cada um ou cada grupo de 2, 3, 4 alunos. Poderão lixar, se quiserem, ou você poderá trazer os pregos lixados (só para garantir que haja mesmo área de contato entre o ferro e a água sanitária). Então, os alunos poderão usar uma lupa e verificar se os dois pregos são idênticos. Farão, então, anotações sobre o que observam. As imagens abaixo poderão ser utilizadas nesta atividade, juntamente com o slide que projeta a atividade, caso você disponha de um projetor.
Depois que estudantes fizerem anotações, eles poderão mergulhar um dos pregos em água sanitária, retirando em seguida. Então, este prego poderá ficar apoiado em uma tampinha de conserva, enquanto a reação ocorre. O tempo mínimo que deve ser esperado para ver alguma mudança é de 6 minutos. Essa reação acontece mais rapidamente se o prego for mergulhado na água sanitária e depois for deixado ao ar, como sugerido. Isso porque além de vir o oxigênio do hipoclorito para ocorrer sua reação de oxidação, ocorre também a reação com o oxigênio do ambiente.
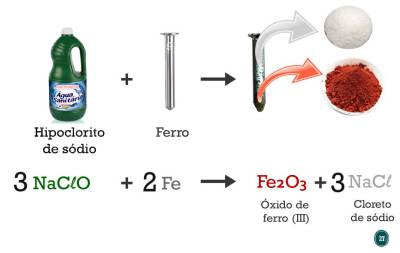
Sendo assim, se você quiser, pode trabalhar com os estudantes as duas reações de oxirredução, a que foi mostrada anteriormente entre Fe e O2 e a reação do Fe com o NaClO presente no hipoclorito. Essa segunda reação é apresentada nos slides a seguir.
Novamente, depois de ter mostrado a reação química do ponto de vista macro pro microscópico, vocês podem trabalhar no quadro o que acontece em termos de perdas e ganhos de elétrons. Primeiramente, sugiro que seja feito o balanceamento passo a passo com os alunos, porque mesmo estando no segundo ano eles podem apresentar dificuldades. Após, é observado que o ferro passa de 0 para 3+, e o cloro de 1+ para 1-. O sódio permanece sendo 1+ e o oxigênio sendo 2-.

Por fim, é trabalhado as diferenças de nomenclatura.
No fim dessa aula você pode entregar a atividade a seguir para os alunos trazerem na próxima aula, onde será feito um grande círculo e apresentado o que cada um (ou grupos) escreveu e pesquisou. Sugiro que seja feito um grande círculo pois os alunos sempre ficam sentados virados para frente, nunca conseguem ver a todos ao mesmo tempo. A apresentação em círculo seria algo diferente do tradicional.
.Você pode baixar os materiais citados neste post clicando nos links abaixo 😀
Downloads
> Sequência didática – Oxirredução com um problemão (pdf)
Aqui você também encontra em anexo as atividades mostradas nas imagens.> Slides das aulas Oxirredução com um problemão (ppt)
Os slides de todas as aulas. Nestes slides há algumas anotações. Essa é a versão do professor. Sugiro que seja dado esses slides para os alunos também, para que possam imprimir e fazer as anotações durante as aulas. Sendo assim, caso não queria disponibilizar o ppt, você por ir em “salvar como” e salvar a versão em pdf para os alunos. Assim eles poderão imprimir 4 slides por página :). Acredito que se você dispõe de um projetor é uma boa opção, porque ficar passando tudo no quadro pode desperdiçar muito tempo da aula.
Bom, então é isso. Espero que tenham gostado. Montei esses slides com muuuito carinho 😀
Não deixem de comentar o que acharam, novas ideias ou como foi essa aula com sua turma.
Se quiserem podem compartilhar, imprimir ou enviar por e-mail clicando nos botões abaixo.
Até o próximo post!































Sensacional essa aula! Obrigada por disponibilizar essa aula enriquecedora 🙂
Que bom que gostou! ♥
[…] uma aula antiga aqui no blog sobre reações redox que elaborei na faculdade, “Oxirredução com um problemão“. Lá a proposta discute o porquê de não poder usar água sanitária pra limpar tudo […]
Excelente abordagem
Que bom que gostou, Jaqueline! Voltei a publicar. Se quiser, se inscreva por e-mail para receber as postagens novas. 😊
Muito útil esse blog! Conheci agora e já amei.
Que bom que achou útil, Jamylly! Fico realmente muito feliz. Acompanhe semanalmente se quiser, voltei a postar 😊. Pode se cadastrar por e-mail
coloque suas referencias aqui dos seus material para uso
Oi Janice. Quais referências? As que eu usei ou como você poderia referenciar esta publicação? As referências que usei se encontram dentro dos arquivos que disponibilizei pra download logo acima 🙂